Contrôle de la matière 'Marqueurs moléculaires et Amélioration
des plantes' du module 'Biotechnologies et amélioration des plantes',
parcours 'Biologie appliquée aux productions végétales', S6, Juin 2018 ", Faculté Sciences-Semlalia, Université Cadi Ayyad, Marrakech, Maroc. Durée : 75 minutes
Cet examen traite les tests d'incorporation du transgène dans les plants du Bouleau (Betula platyphylla) et l'expression de la résistance au lépidoptère Lymantria dispar (Bombyx disparate)
.......... Corrections brèves à la fin de l'épreuve ---->
Liens à contenu similaire
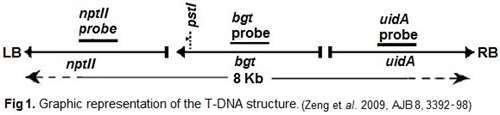
Afin d'améliorer la résistance du bouleau (Betula platyphylla Suk) au lépidoptère Lymantria dispar (Bombyx disparate), Zeng et al., 2009 (AJB 8, 3392-98) ont produit des plantes transgéniques exprimant le gène bgt codant pour une protéine insecticide (BGT) résultant de la fusion d'une toxine produite par l'araignée (Atrax robustus) et la toxine Cry IA (b) de la bactérie Bacillus thuringiensis.

Le transfert a été réalisé par Agrobacterium tumefaciens hébergeant un T-DNA avec le gène bgt et les gènes de la néomycine phosphotransférase (nptII)
et de la béta-glucuronidase (uidA ou gus) (fig. 1). L'ADN et
l'ARN des plantes sont préparés à partir des feuilles.
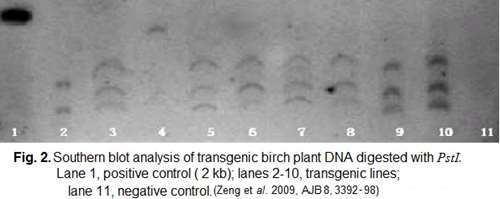
L'ADN génomique a été hydrolysé par l'enzyme
de restriction PstI et séparé par électrophorèse
sur gel d'agarose 0,8%. Après transfert sur membrane et hybridation
avec la sonde bgt, les résultats sont montrés dans la
figure 2. Après élimination de la sonde bgt, la membrane
a été révélée de nouveau avec la
sonde gus (uidA). Le résultat obtenu est montré dans la
figure 3.
L'ARN total a été séparé par électrophorèse
sur gel d'agarose 1%. Après transfert sur membrane, l'hybridation
a été réalisé par la sonde bgt. Le résultt
est montré dans la figure 4.
Le niveau d'expression en protéine BGT a été suivi
par ELISA avec quantification des protéines. Les résultats
sont montrés dans le tableau 1. L'effet insecticide de la protéine
BGT a été test par impact des larves de Lymantria dispar
sur les plantes de Betula platyphylla transformées et non transformées
(Fig.5).




1. A l'aide d'un tableau comparer
les marqueurs RFLP et ceux basés sur la PCR, utilisés
dans la détermination du nombre de copies de transgènes
intégrés dans un génome.
2. Quelle(s) est (sont) la (les)
figure (s) pouvant rendre compte du nombre de copies du transgène
bgt integrées dans le génome des plantes ayant subi la
transformation.
3. Comparer le nombre de copies
du transgène bgt et du gène gus integrées dans
le génome des plantes. Proposer des hypothèse explicatives.
4. En exploitant le tableau 1 et
les autres figures, préciser le niveau d'expression (échelle
de la transcription) du transgène intégré dans
le génome des plantes. Proposer des hypothèse explicatives.
5. A l'aide du tableau 1, déterminer
s'il existe une relation entre le taux de la protéine insecticide,
le nombre de copie du transgène et le niveau d'expression.
6. En s'inspirant de la figure 5,
évaluer les apports positifs et négatifs de l'usage de
la transformation génétique du bouleau pour la résistance
au lépidoptère Lymantria dispar.




REPONSES. DETAILS
Réponse à la Question 1:Détermination du nombre de copies du transgène. Usages des marqueurs RFLP et ceux basés sur la PCR.
| Etape | RFLP | PCR cas de la PCR inverse |
| Purification de l'ADN | Requise | Requise |
| Digestion par une enzymes de restriction coupant dans: | le transgène | la région bordant le gène |
| Ligation après coupure | Non | Oui |
| Deuxième hydrolyse sur le transgène | Non | Oui |
| Amplification de l'ADN, amorces spécifiques du transgène | Non | Oui |
| Transfert (Southern blot) | Oui | Non |
| Détection par hybridation avec une sonde spécifique du transgène | Oui | Non |
Lien:
Nombre
de copies du transgène intégré
Réponse
à la Question 2: La (les) figure (s) pouvant rendre compte
du nombre de copies du transgène bgt integrées dans le
génome des plantes ayant subi la transformation. Ce sont
la figures 2 et 3 correspondant au southern blots. La figure 3 correspondant
à l'hybridation avec une sonde détectant le gène
gus (gène marqueur) lié au transgène bgt (gène
d'intérêt), peut rendre compte indirectement du nombre
de copies du transgène. La coupure par l'enzyme pstI se fait
dans le transgène. La majorité des plantes (6/9, environ
67%) incorporent 3 copies du transgène. Une à deux plantes
incorporent 4 copies. Une seule plante avec une copie et une autre avec
deux (Fg.2).
Réponse
à la Question 3: Comparaison du nombre de copies du transgène
bgt et du gène gus integrées dans le génome des
plantes. Quelles hypothèse explicatives ?.
La figure 3 montre que le nombre de copies deu transgène bgt
et du gène gus ne concordent pas. Ainsi, la plante TP69 présente
3 copies de bgt et 4 copies de gus. Ceci peut être expliqué
par des réarragements et des délétions de gènes
lors de l'intégration de l'ADN T.
Réponse
à la Question 4: le niveau d'expression (échelle
de la transcription) du transgène intégré dans
le génome des plantes. Quelles hypothèse explicatives?
Lintensité des bandes de la figure 4, montre que le niveau d'expression
(échelle de la transcription) du bgt est différent d'une
plante à l'autre. L'expression est élevée chez
les plantes TP28, TP46 et TP58. Cependant les plantes TP30 et TP96 n'expriment
pas le gene bgt
Réponse
à la Question 5:y a-t-il une relation entre le taux de
la protéine insecticide, le nombre de copie du transgène
et le niveau d'expression ?.
L'absence de la protéines BGT dans les plantes TP30 et TP 96
est en accord avec l'absence de transcrits ARNm, montré par la
figure 4 (Northern
blotting), malgré que ces plantes contenaient une et 4 copies
du transgène, respectivement. La protéine BGT est bien
représentée chez les plantes TP23 et TP28, porteuse respectivement
de tois et une copies du transgène bgt. Tous ces résultats
montre l'absence de corrélations entre le nombre de copies du
transgène et son expression en protéine BGT.
Réponse
à la Question 6:
Les apports positifs et négatifs de l'usage de la transformation
génétique du bouleau pour la résistance au lépidoptère
Lymantria dispar. Les tests biologiques confirment bien la toxicité
des plantes transgéniques de Betula platyphylla envers les larves
de Limantria. Les apports positifs de cette transformation peuvent se
résumer dans l'élimination d'usage excessif des insecticides
pour lutter contre les lépidoptères (protection de l'environnement).
Néanmoins, le transfert horizontal du transgène à
d'autres espèces les rendant toxiques pour d'autres insctes non
nuisibles et la pollution génique (transfert du pollen sur d'autres
espèces), restent des risques à en tenir compte.
LIENS UTILES
- Plantes. Transgénèse,
génie génétique
- Transformation sens (chitinase)
- Chitinase engineered plants
- Chitinase. Tests
- RFLP
et sélection des protoplastes chez l'oranger. Examen S5_2012
- RFLP,
RAPD et sélection chez le Cyprès du Japon (examen 2013)
- RAPD
et sélection de la tomate. Examen S5_2012
- Microsatellites
(SSR) et transgénèse chez le niébé. Examen
S6 2017
- Polygalacturonase.
Transformation (contrôle)
- Faire un Quiz formatif (Contrôle noté) sur les Biotechnologies des Plantes et Marqueurs moléculaires
ENSEIGNEMENT DE MASTER
- -
- Cours du Master Biotechnologies et Amélioration des Plantes, Marrakech
- Travaux pratiques Master Biotechnologies et Amélioration des Plantes, Marrakech
Biotech-ecolo. net. SUPPORTS
CHAINE YOUTUBE
Chaine Youtube (abonnement). Plusieurs vidéos multilingues (+ s/titres) aux sujets des Biotechnologies et Biochimie