

Contrôle de l'élément de module 'Génétique et Amélioration des plantes' (partie 'marquage moléculaire et amélioration des plantes'), module 'Biochimie, Génétique et Amélioration
des Plantes' du Parcours S5 : 'Biologie Appliquée aux Productions Végétales', Janvier 2014", Durée : 60 minutes.
Cet examen porte sur le test de paternité et la détection précoce d'hybrides chez le coton par utilisation des marqueurs moléculaires basés dur la PCR, à savoir la RAPD et les microsatellites.
.......... Corrections brèves à la fin de l'épreuve

En projetant la mise au point de marqueurs moléculaires adéquats pour l'étiquetage des ressources génétique de coton, Asif et al. (Pak. J. Bot. 42, 695-701, 2009) ont testé les marqueurs de types RAPD (polymorphisme d'amplification aléatoire de l'ADN) et SSR (microsatellites) sur deux génotypes de coton pris comme parents male et femelle (P1 et P2) et leur première progéniture (F1), obtenue par croisement dirigé. Les auteurs ont procédé par la purification de l'ADN à partir des feuilles de coton selon la méthode au CTAB (Murray & Thompson, 1980) où le mélange chloroforme-alcool isoamylique (24v :1v) a été utilisé. Une étape de traitement par la RNase à 37°C pendant 1 heure, a été intégrée dans le protocole de purification de l'ADN. L'amplification de l'ADN a été réalisée par la technique PCR (polymérisation en chaîne de l'ADN) pour générer un marquage RAPD en utilisant 3 amorces de 10 nucléotides (OPM-07, OPU-01 et OPV-01), d'une part et un marquage de type SSR en utilisant 3 amorces appelées MGHES-06, MGHES-17 et MGHES-24, d'autre part. L'électrophorèse des fragments d'ADN a été réalisée sur des gels d'agarose à 1,2% pour les marqueurs RAPD et des gels d'agarose Metaphor 2% (mélange d'agarose 2% et d'agarose métaphor 2%). Les électrophorégrammes obtenus pour les deux types de marquages et les données relatives aux amorces utilisées sont représentés dans le tableau et les figures 1 et 2.


1. Rappeler brièvement les rôles du CTAB, mélange chloroforme-alcool isoamylique (24v :1v) et RNase dans la purification de l'ADN.
2. Rappeler les principales étapes d'un protocole PCR.
3. Quelles sont les origines d'un polymorphisme de type RAPD ?
4. Quelles sont les origines d'un polymorphisme de type SSR ?
5. A l'aide d'un tableau, comparer les marqueurs moléculaires de type RAPD et SSR (nature des amorces, étapes principales de la PCR, enzymes utilisées, gels d'électrophorèse fréquemment utilisés dans la séparation des fragments d'ADN, reproductibilité et déterminisme de dominance codominance).
6. Donner les raisons possibles du choix des gels d'agarose 1,2% et d'agarose Metaphor 2% utilisés respectivement dans l'électrophorèse de l'ADN résultant des techniques RAPD et SSR appliquées aux ressources génétiques
du coton.
7. Parmi les amorces utilisées
par les auteurs dans les marquage RAPD et SSR des ressources génétiques
du coton, choisir celle(s) susceptible(s) de renseigner sur la paternité
des progénitures de coton et celles pouvant être proposées
pour la détection précoce des hybrides. Justifier votre
réponse.
Corrections
brèves
---> Revenir aux questions
Réponse
à la Question 1: Rôles du CTAB, mélange chloroforme-alcool isoamylique (24v :1v) et
RNase dans la purification de l'ADN.
- CTAB est un détergent cationique qui permet la rupture des structures
lipidiques des membranes et fixe les polysaccharides.
- Le mélange chloroforme-alcool isoamylique (24v :1v) permet
la formation des phases dont la phase acqueuse (phase supérieure)
contenant l'ADN (+ ARN).
- RNase permet d'éliminer l'ARN copurifié avec l'ADN.
Liens utiles : Purification de l'ADN.
Réponse à la Question 2: Etapes Principales d'un protocole PCR:
- Dénaturation à une température d'environ 94°C pendant un temps de 1-2 minutes, environ. Ceci permet la séparation de l'ADN bicaténaire en ADN monocaténaire.
- Fixation des amorces à une température d'environ 36°C pendant 1 minute, environ.
- Elongation ou polymérisation de l'ADN par l'enzyme Taq DNA polymerase en présence des nucléotides dXTP et de Mg++. Cette étape est réalisée à 72°C pendant 1-2 minutes.
- Répétition du cycle 40-60 fois
Réponse à la Question 3: Origines du polymorphisme de type RAPD
Les causes du polymorphisme de type RAPD sont:
- Disparition par mutation d'un ou plusieurs sites de fixation de l'amorce.
- Eloignement, par insertion, des sites de fixation de l'amorce à une distance supérieure à 3000 pb. Il en résulte la disparition de fragments de DNA.
- Rapprochement, par délétion, des sites de fixation de l'amorce à une distance inférieure ou égale à 3000 pb. Il en résulte l'apparition de fragments surnuméraires.
- Rapprochement très accusé des sites de fixation de l'amorce ne donnant lieu qu'à de petits fragments de DNA n'apparaissant pas sur le gel après électrophorèse. Lien: Marqueurs RAPD
Réponse à la Question 4: Origines du polymorphisme de type SSR (microsattelites).
Les microsatellites (SSR) sont constitués de séquences de di-, tri- ou tétra-nucléotides répétés en tandem. Le polymorphisme de type SSR repose sur la variation du nombre d'unités de répétition constituant le microsatellite. Parmi les caractéristiques principales, il y'a le multiallélisme. Lien: Marqueurs SSR (microsatellites).
Réponse à la Question 5: Comparaison des marqueurs moléculaires de tpe RAPD et SSR (nature des amorces, étapes principales de la PCR, enzymes utilisées, gels d'électrophorèse fréquemment utilisés dans la séparation des fragments d'ADN, reproductibilité et déterminisme de dominance codominance).

 |
 |
 |  |
Lien utile: Marqueurs RAPD et SSR
Réponse à la Question 6: les raisons possibles du choix des gels d'agarose 1,2% et d'agarose Metaphor 2% utilisés respectivement dans l'électrophorèse de l'ADN résultant des techniques RAPD et SSR appliquées aux ressources génétiques du coton:
Les marqueurs de types SSR peuvent être de petite taille et nécessitent des gels de polyacrylamide ou des gels d'agarose plus concentrés pour réussir leur séparation. Les fragments d'ADN de séquences courtes, étant de migration rapide, peuvent sortir de façon précoce des gels moins concentrés. Les marqueurs de type RAPD, étant de taille moyenne, les gels d'agarose 0,8%-1,5% restent convenables pour la séparation.
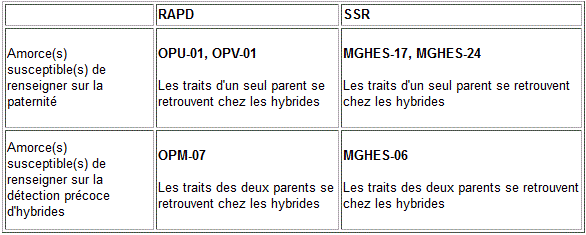
Réponse à la Question 7: Les amorces utilisées par les auteurs dans les marquage RAPD et SSR des ressources génétiques du cotonsusceptibles de renseigner sur la paternité des progénitures de coton et celles pouvant être proposées pour la détection précoce des hybrides.
--> VIDEO EXPLICATIVE:
-->
LIENS UTILES:
- Sélection Assistée par Marqueurs (MAS)
- Autogames, allogames. Exercice
- Sélection des
plantes autogames. Exercice
- Sélection des
plantes allogames. Exercice
- RFLP et sélection des
protoplastes chez l'oranger. Examen S5_2012
- RAPD et amélioration
de la tomate pour la résistance à la verticilliose, RFLP.
Examen S5_2012
- RFLP, RAPD et sélection
chez le Cyprès du Japon (examen 2013)
- SSR (microsatellites) et mildiou de la tomate (Examen S5, 2013)
- Marqueurs PCR de type RAPD et microsatellites chez coton (Contrôle S5, 2014)
- Isoenzymes et détection d'hbrides interspécifique chez Cuphea
- Test de la pureté des semences par RAPD et SSR (Contrôle S5, 2019)
- RAPD
- AFLP
- SSR
- Faire un Quiz formatif (Contrôle noté) sur les Biotechnologies des Plantes et Marqueurs moléculaires
CHAINE YOUTUBE Chaine Youtube (abonnement). Plusieurs vidéos multilingues (+ s/titres) aux sujets des Biotechnologies et Biochimie
 Glossaire trilingues Français-Arabe-Anglais
Glossaire trilingues Français-Arabe-Anglais
- - Cours du Master Biotechnologies et Amélioration des Plantes, Marrakech
- Travaux pratiques Master Biotechnologies et Amélioration des Plantes, Marrakech